康盾科技:口罩廠建造生產全套攻略
工藝流程圖
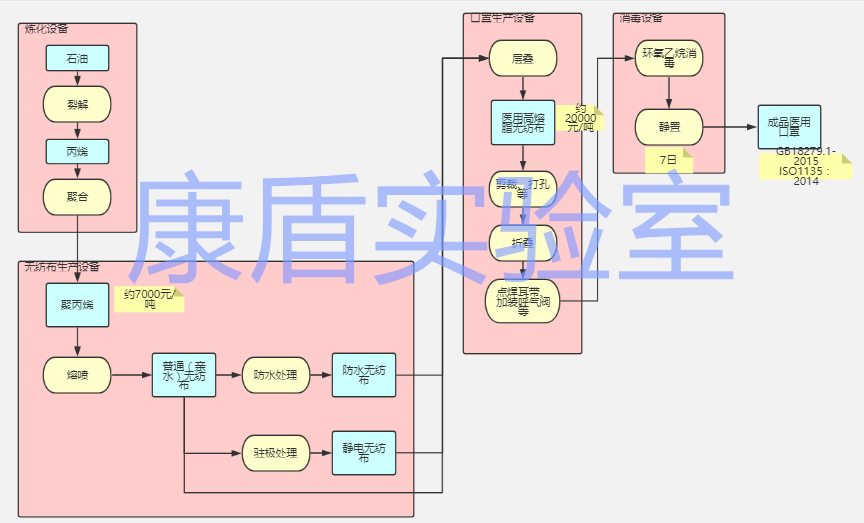
原材料
醫(yī)用口罩一般由以下材料構成:
主體材料:常見的醫(yī)用口罩,主要由三層無紡布組成。內層是普通無紡布;外層是做了防水處理的無紡布,主要用于隔絕患者噴出的液體;中間的過濾層用是聚丙烯熔噴無紡布(有的經過駐極處理,靜電駐極能提高過濾效率、降低過濾阻力也有所下降,甚至對纖網的均勻性也有所改善。)
其他材料包括金屬(用于鼻夾)、染色劑、彈性材料(用于口罩帶)等
其中起到主要作用的是主體過濾材料PP熔噴布。平面型口罩濾材的主要性能指標為細菌過濾效率BFE,過濾級別有:普通級、BFE95(濾效95%)、BFE99(濾效99%)、VFE95(濾效99%)、PFE95(濾效99%)、KN90(濾效90%)。
企業(yè)應根據所要生產的口罩種類選擇濾材的過濾效率以及克重。例如一次性醫(yī)用口罩一般選擇20g/m2的BFE95熔噴布,但是N95口罩一般用40g/m2,防護效果更好。
選擇濾材供應商時應注意索要濾材的BFE過濾效率報告,目前國際上比較公認的權威機構有美國NELSON(尼爾森試驗室)和NIOSH(美國職業(yè)安全與健康國立研究所)。
此外,如果生產醫(yī)用口罩,應關注原材料的生物學相容性。如果供應商能夠提供原材料的生物學試驗報告(細胞毒、皮膚刺激、遲發(fā)型超敏試驗),將能節(jié)省口罩成品的生物學評價的時間其費用。歐洲 EN ISO 14683:2014以及ASFMF2100的口罩濾材的標準分別如下表所示,供參考。
ENISO 14683:2014醫(yī)用口罩濾材的分類
ASTMF2100口罩濾材的要求
目前市場上口罩原材料的供應也并不是非常充裕,下圖提供了部分供應商的聯系方式,供參考(來源于網絡,真實性無法保證)。此外這篇文章《N95口罩是什么材料做成的?國內都有哪些石化生產相關原材料?》中也列出了31家國內高熔指纖維生產企業(yè),可參考。
口罩檢驗要求及檢驗機構
醫(yī)用口罩產品的檢測包括出廠檢驗和型式檢驗。出廠檢驗項目至少應有以下項目:外觀、結構與尺寸、鼻夾、口罩帶、微生物指標、環(huán)氧乙烷殘留量(若采用環(huán)氧乙烷滅菌)的要求。考慮原材料的進貨檢驗以及口罩的出廠檢驗,企業(yè)應配置基本的檢驗儀器,如電子天平、測力計、千分尺、游標卡尺、直尺、白度儀等。如果微生物指標和環(huán)氧乙烷殘留量均自測,則需要有微生物實驗室及相應的儀器。
型式檢驗應為產品標準的全性能檢驗,應選擇有資質的檢驗所。如果是民用口罩,選擇有CMA資質的檢測所。如果是醫(yī)用口罩,應選擇藥監(jiān)局認可的醫(yī)療器械檢驗所。目前各大醫(yī)療器械檢驗所均忙于檢測醫(yī)用防護器械。
此外,市場監(jiān)管總局也公布了獲國家級資質認定的醫(yī)療器械防護用品檢驗檢測機構名錄,詳見鏈接:市場監(jiān)管總局公布獲國家級資質認定的醫(yī)療器械防護用品檢驗檢測機構名錄。
廠房設施及生產設備要求
無菌口罩一般要在10萬級潔凈車間生產。如果企業(yè)新建潔凈廠房是一筆不小的投入,時間上也不一定來得及。此點需要考慮。
口罩的生產一般是全自動或者半自動的。全自動設備包括全自動平面口罩機、全自動折疊口罩機等。半自動的設備包括口罩成型機、口罩壓合機、口罩切邊機、呼吸閥沖孔機(若有呼吸閥)、鼻梁條線貼合機、耳帶點焊機、呼吸閥焊接機(若有呼吸閥),一般全套大概要50萬左右。但是目前口罩生產設備缺貨,交期基本要60天左右。
需要注冊的是,如果生產無菌醫(yī)用口罩,則會涉及到滅菌工序。目前絕大部分企業(yè)選擇的是環(huán)氧乙烷(EO滅菌)。不推薦輻照滅菌,據說輻照滅菌可能導致細胞過濾效率不通過。
如前文所說,環(huán)氧乙烷滅菌的口罩需要進行解析。因為環(huán)氧乙烷滅菌后,口罩上會有環(huán)氧乙烷殘留,而環(huán)氧乙烷是一種有毒的致癌物質,長期吸入環(huán)氧乙烷,不但刺激呼吸道,還會有強烈的致癌可能性。長期少量接觸,可見有神經衰弱綜合征和植物神經功能紊亂。所以必須通過解析的方式使得口罩上殘留的環(huán)氧乙烷釋放,從而達到安全含量標準。因此經環(huán)氧乙烷滅菌的醫(yī)用口罩,必須經過解析,經檢測合格才能出廠上市。需要解析14天。這是企業(yè)經過驗證的環(huán)氧乙烷解析時間,能確保口罩中殘留的環(huán)氧乙烷含量低于10ug/g的安全標準。
另外,環(huán)氧乙烷滅菌的口罩應選用透氣的包裝材料。否則難以達到滅菌效果。
質量管理體系及注冊資料要求
如果要申報醫(yī)用口罩,則必須建立符合《醫(yī)療器械生產質量管理規(guī)范》的質量管理體系,并且按照要求編寫相應的應急備案資料或者注冊管理資料,還要經過現場核查。對于無醫(yī)療器械行業(yè)從業(yè)經驗的企業(yè)來說,這是不小的挑戰(zhàn)。其中涉及的要求非常多,此處不一一贅述。
注冊要求
一、醫(yī)用口罩的標準及重要技術指標
目前,作為醫(yī)療器械管理的口罩包括醫(yī)用防護口罩、醫(yī)用外科口罩和普通醫(yī)用口罩,普通脫脂紗布口罩不作為醫(yī)療器械管理。作為醫(yī)療器械管理的口罩,其標準和重要技術指標要求如下:
(一)醫(yī)用防護口罩
符合GB19083-2003《醫(yī)用防護口罩技術要求》標準,重要技術指標包括非油性顆粒過濾效率和氣流阻力:
1.過濾效率:在空氣流量(85±2)L/min條件下,對空氣動力學中值直徑(0.24±0.06)μm氯化鈉氣溶膠的過濾效率不低于95%,即符合N95(或FFP2)及以上等級。
2.吸氣阻力:在上述流量條件下,吸氣阻力不超過343.2Pa(35mmH?2O)。
(二)醫(yī)用外科口罩
符合YY 0469-2004《醫(yī)用外科口罩技術要求》標準,重要技術指標包括過濾效率、細菌過濾效率和呼吸阻力:
1.過濾效率:在空氣流量(30±2)L/min條件下,對空氣動力學中值直徑(0.24±0.06)μm氯化鈉氣溶膠的過濾效率不低于30%;
2.細菌過濾效率:在規(guī)定條件下,對平均顆粒直徑為(3±0.3)μm的金黃色葡萄球菌氣溶膠的過濾效率不低于95%;
3.呼吸阻力:在過濾效率流量條件下,吸氣阻力不超過49Pa,呼氣阻力不超過29.4Pa。
(三)普通醫(yī)用口罩
符合相關注冊產品標準(YZB),一般缺少對顆粒和細菌的過濾效率要求,或者對顆粒和細菌的過濾效率要求低于醫(yī)用外科口罩和醫(yī)用防護口罩。
二、醫(yī)用口罩的適用范圍
按照各類醫(yī)用口罩符合的標準和重要技術指標要求,醫(yī)用防護口罩適用于醫(yī)務人員和相關工作人員對經空氣傳播的呼吸道傳染病的防護,防護等級高;醫(yī)用外科口罩適用于醫(yī)務人員或相關人員的基本防護,以及在有創(chuàng)操作過程中阻止血液、體液和飛濺物傳播的防護;普通醫(yī)用口罩對致病性微生物的防護作用不確切,可用于普通環(huán)境下的一次性衛(wèi)生護理,或者致病性微生物以外的顆粒如花粉等的阻隔或防護。
三、有關要求
醫(yī)用口罩屬于第二類醫(yī)療器械。各省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門應當根據《關于加強醫(yī)用口罩監(jiān)管工作的通知》(食藥監(jiān)辦械〔2009〕95號)的要求,加強對轄區(qū)內已批準的醫(yī)用口罩采用標準的監(jiān)管,嚴格要求有關企業(yè)按照國家標準、行業(yè)標準或注冊產品標準組織生產并規(guī)范使用說明書和包裝標識,指導醫(yī)療機構和公眾根據使用目的選擇合適的口罩。
各種含有滅菌、抑菌和抗病毒的成分,預期用于抗菌抗病毒的醫(yī)用口罩按第三類醫(yī)療器械管理。目前,國家局尚未批準過此類產品。有關生產企業(yè)應當按照相關規(guī)定向國家局申請注冊,經批準獲得醫(yī)療器械注冊證書后方可生產和銷售。
口罩的分類
從使用途徑上講,口罩可分為民用口罩和醫(yī)用口罩。民用口罩無需像醫(yī)用口罩那樣進行注冊,只需按照GB/T 32610-2016取得第三方檢驗報告即可生產。
1、根據《醫(yī)療器械分類目錄》,醫(yī)用口罩有2種,如下圖:
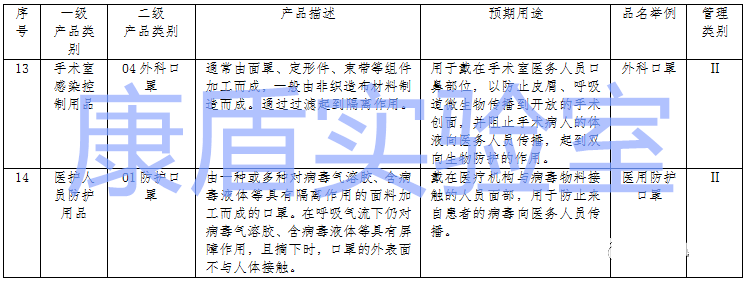
2、根據國家局《醫(yī)用口罩產品注冊技術審查指導原則》,以產品的預期用途和適用范圍為依據,一般分為醫(yī)用防護口罩、醫(yī)用外科口罩和一次性使用醫(yī)用口罩。
醫(yī)用防護口罩適用于醫(yī)務人員和相關工作人員對經空氣傳播的呼吸道傳染病的防護。
醫(yī)用外科口罩適用于醫(yī)務人員或相關人員的基本防護,以及在有創(chuàng)操作過程中阻止體液和噴濺物傳播的防護。
一次性使用醫(yī)用口罩適用于佩戴者在不存在體液和噴濺風險的普通醫(yī)療環(huán)境下的衛(wèi)生護理。
其實,大家可以看出,《醫(yī)用口罩產品注冊技術審查指導原則》中沒有一次性使用醫(yī)用口罩,它屬于哪個分類呢,根據最新醫(yī)療器械分類界定,其為分類編號141400,屬于醫(yī)護人員防護用品,為二類醫(yī)療器械。
由此我們可以看出,醫(yī)用口罩全部屬于二類醫(yī)療器械,如果要做口罩生產,必須進行相應設計研發(fā),在符合GMP的條件下生產樣品,并按《醫(yī)療器械注冊管理辦法》進行編寫產品技術要求,送注冊檢驗、準備注冊資料,進行產品注冊,由于其在免臨床目錄中,所以不需要做臨床試驗,但需進行臨床評價,提交申報產品與已上市同類產品的對比說明。對比說明應當包括工作原理、產品材質、結構組成、主要技術性能指標、消毒/滅菌方法、預期用途、是否家庭使用等內容。
醫(yī)用口罩的組成結構
醫(yī)用口罩一般由熔噴布、無紡布、口罩帶、鼻夾組成,其中外層和內層均采用無紡布、中層采用熔噴布。口罩最外層具有防飛沫設計,中間層是核心功能層,用于過濾飛沫、顆粒或細菌,內層主要吸濕。
主體過濾材料為聚丙烯熔噴布,是一種超細靜電纖維布,由于靜電作用可以捕捉粉塵,含有各類病毒的飛沫接近聚丙烯熔噴布后,能被吸附在熔噴布表面,無法穿透。適合平面口罩熔噴過濾級別有:普通級、BFE95(濾效95%)、BFE99(濾效99%)、VFE95(濾效99%)、PFE95(濾效99%)、KN90(濾效90%)。熔噴布一般選用20克重,克重越高,防護過濾效果越好,N95的采用40克重甚至更高。當然,如果無紡布層過多,口罩就比較硬,而熔噴層過多,則呼吸比較困難,
其他材料:金屬(用于鼻夾)、染色劑、彈性材料(用于口罩帶)等。
醫(yī)用口罩工作原理
醫(yī)用口罩大部分為自吸式過濾口罩,其工作原理是使含有害物的空氣通過口罩的濾料過濾后再被人吸入或者呼出。口罩濾料的過濾機理主要有以下幾種
(見圖2):

圖2 濾料纖維過濾機制示意圖
1. 擴散沉積:粒子布朗運動擴散位移到過濾纖維,受分子引力作用而被吸附。最易捕捉小尺度粒子、細纖維和低速運動的粒子。
2. 截留沉積:隨氣流運動的較大粒子被過濾材料的機械篩濾作用截留。粒子直徑與濾膜纖維的直徑的比率影響攔截效率。
3. 慣性沉積:粒子通過過濾材料彎曲的網狀通道時,粒子由于慣性作用脫離氣流撞擊過濾纖維,并受分子引力作用被截留。大粒子、高密度、速度快時截留效果好。
4. 靜電吸引沉積:粒子被過濾纖維的靜電作用產生的沉積。
顆粒越小時,1、4沉積效應越強,顆粒越大時,2、3效果越好,所以并非越小的顆粒越難被過濾。綜合4種過濾機制的協同作用,普通機械性濾料最易穿透粒徑的范圍是0.1μm~0.3μm。
醫(yī)用口罩適用的相關標準
醫(yī)用口罩產品應根據自身特點適用以下標準,但不限于引用以下標準:
相關產品標準
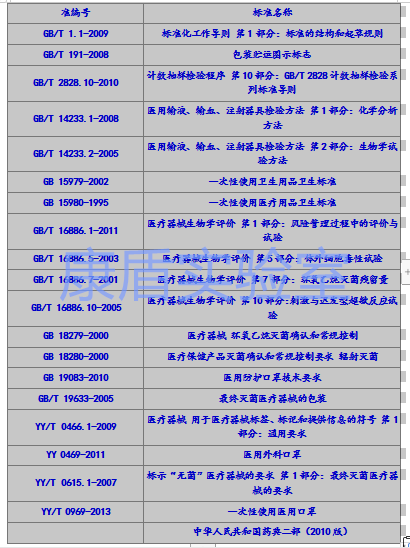
其中:
1. 醫(yī)用防護口罩:應符合GB19083-2010《醫(yī)用防護口罩技術要求》;
2. 醫(yī)用外科口罩:應符合YY 0469-2011《醫(yī)用外科口罩》;
3. 一次性使用醫(yī)用口罩:應符合YY/T 0969-2013《一次性使用醫(yī)用口罩》要求。
具體詳見下圖:

醫(yī)用口罩生產流程及設備
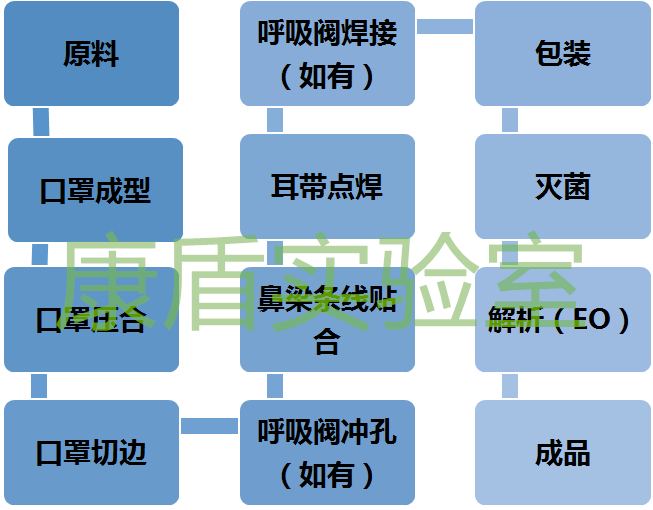
醫(yī)用口罩一般為無菌,其中一次性使用醫(yī)用口罩有無菌和非無菌兩種,其他醫(yī)用口罩均為無菌產品,都應在10萬級無菌潔凈廠房生產,其廠房要求較為苛刻,應有空調凈化系統、純化水系統在從原料進廠,需經過口罩成型、壓合、切邊、呼吸閥焊接(如有)、耳帶點焊、鼻梁條線貼合、呼吸閥沖孔(如有)、包裝、滅菌、解析(EO滅菌)方可制造完成。
 全自動一拖二口罩生產設備
全自動一拖二口罩生產設備
為實現以上制造過程,需配置全自動生產設備或半自動生產設備。全自動設備是一體成型,一般1臺本體機拖2到3臺耳帶機,從原料投料到包裝完成都可實現。而半自動設備則需按以上流程逐個配置,包括口罩成型機、口罩壓合機、口罩切邊機、呼吸閥沖孔機、鼻梁條線貼合機、耳帶點焊機、呼吸閥焊接機等。
醫(yī)用口罩的滅菌
對于生產的醫(yī)用無菌口罩,必須通過滅菌工序方可放行。對于跨界進行入口罩行業(yè),這無疑是個門檻。滅菌可以通過委托滅菌,也可以購買滅菌設備自行滅菌。市面上一般由環(huán)氧乙烷(EO)滅菌和輻照滅菌兩種方式。考慮到輻照滅菌劑量控制不好會對熔噴布帶來影響導致過濾效率不符合要求,所以絕大部分企業(yè)都選用EO滅菌。由于EO滅菌使用的是有毒有害的環(huán)氧乙烷,所以滅菌后還需進行解析,分為自然解析和滅菌柜解析。一般而言,自然解析的周期約為14天,才能確保口罩中殘留的環(huán)氧乙烷達標。
醫(yī)用口罩的檢測要求
醫(yī)用口罩產品的檢測包括出廠檢驗和型式檢驗。
出廠檢驗項目至少應有以下項目:外觀、結構與尺寸、鼻夾、口罩帶、微生物指標、環(huán)氧乙烷殘留量(若采用環(huán)氧乙烷滅菌)的要求。
型式檢驗應為產品標準的全性能檢驗。
相關口罩主要性能指標為:

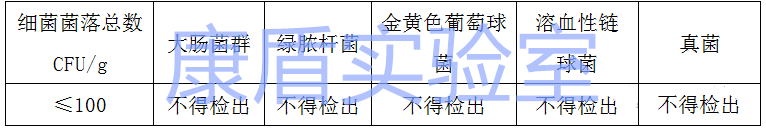
關于微生物指標,滅菌口罩經環(huán)氧乙烷滅菌,應無菌,其環(huán)氧乙烷的殘留量應不超過 10μg/g。對于非滅菌口罩(普通級)應符合下表的要求。
口罩微生物指標
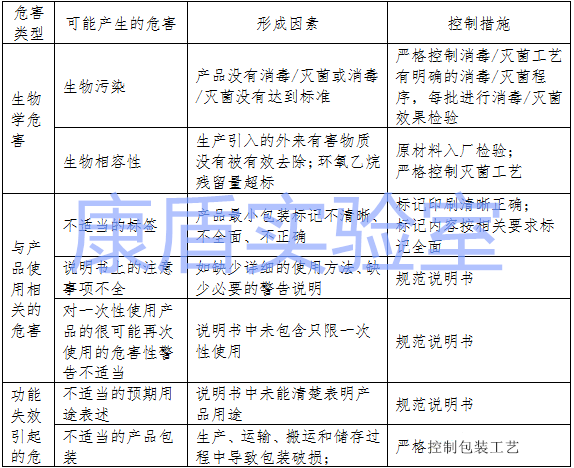
醫(yī)用口罩存在的主要風險
醫(yī)用口罩產品在進行風險分析時應符合YY/T0316-2008《醫(yī)療器械 風險管理對醫(yī)療器械的應用》的要求。企業(yè)在進行風險分析時,至少應考慮表中的主要危害,企業(yè)還應根據自身產品特點確定其他危害。針對產品的各項風險,企業(yè)應采取應對措施,確保風險降到可接受的程度。
產品主要危害表

醫(yī)用口罩其他相關問題
1、鑒于目前對醫(yī)用口罩的過濾材料質量難以通過便捷有效的檢驗方式來控制,生產質量管理體系的規(guī)范運行是企業(yè)保證口罩產品質量穩(wěn)定的主要手段,故在注冊技術審評和體系考核中審核員和檢查員會關注過濾材料的生產工藝及供貨來源。企業(yè)應對產品的過濾材料進行控制,明確過濾材料的來源及質量要求,具有相對穩(wěn)定的生產工藝及供貨來源以保證產品的質量。
2、醫(yī)用口罩是二類醫(yī)療器械,理應走注冊程序。在疫情條件下,部分省份可以進行備案管理,如廣東省明確對于在一級響應期間新增擬開展醫(yī)用口罩、防護服等屬于二類防控器械產品注冊和生產的,憑工信部門意見向所在地市藥監(jiān)局申請備案,市局在備案憑證中應注明“本備案僅在公共衛(wèi)生事件一級響應期間適用”。備案后,按以下方法放行:按照《中國藥典》(2015年版)第三部1101無菌檢測法開展無菌檢驗,在培養(yǎng)七天后未發(fā)現有微生物生長,其他理化指標均檢測合格,可先放行。產品標簽上應按照正常無菌檢測完成時間標注使用的起始時間。企業(yè)在無菌檢驗后續(xù)培養(yǎng)觀察時間內,發(fā)現不符合要求的,應及時召回。
3、醫(yī)用口罩的安全性、有效性只是其起到防護作用的一部分因素。口罩正確的使用及佩戴方法也直接影響了防護的效果。因此在說明書中應明示出使用者需要的全部信息以避免口罩的誤用,降低交叉感染的風險。如注明佩戴方法、明確標識口罩正反面識別方法、使用時間的建議、注明濾料級別或相關說明等。另外,醫(yī)護人員對于不同種類醫(yī)用口罩的適用范圍還沒有十分明確的認識,應在說明書中清楚地注明口罩的適用范圍并加強醫(yī)護人員的培訓工作。
4、無菌醫(yī)用口罩在10萬級潔凈廠房條件下生產,其特點是塵粒最大允許數大或等于0.5微米的粒子數不得超過3500000個,大于或等于5微米的粒子數不得超過20000個。另外,微生物最大允許數,浮游菌數不得超過500個每立方米;沉降菌數不得超過10個每培養(yǎng)皿。同時相同潔凈度等級的潔凈室壓差保持一致,對于不同潔凈等級的相鄰潔凈室之間壓差要≥5Pa,潔凈室與非潔凈室之間要≥10Pa。這主要是為了保障空氣從潔凈區(qū)流向非潔凈區(qū),避免氣流倒灌。溫度一般控制在冬季20——22℃;夏季24——26℃;波動±2℃。冬季潔凈室濕度控制在30-50%,夏季潔凈室濕度控制在50-70%。對溫度、濕度無特殊要求時,以穿著潔凈工作服不產生舒服感為宜。其功能布置、設備設施和管理要求可參考《醫(yī)療器械潔凈室(區(qū))檢查要點指南》。
上一篇:口罩生產制作工藝
下一篇:馬弗爐安裝和使用注意事項